オゾンの生成反応
オゾン層に関する一般的な方程式の例として、オゾンの濃度が時間とともに変化する反応速度方程式を考えてみましょう。
オゾンの生成と消費の反応を考慮し、簡略化されたモデルを使用します。
オゾンの生成反応としては、次の反応を考えます:
$$
O_2 + UV \rightarrow 2O
$$
$$
O + O_2 \rightarrow O_3
$$
オゾンの消費反応としては、次の反応を考えます:
$$
O_3 + O \rightarrow 2O_2
$$
これに基づいて、オゾンの濃度 $ ( [O_3] ) $の時間変化を表す方程式は次のようになります:
$$
\frac{d[O_3]}{dt} = k_1[O_2][UV] - k_2[O][O_2] - k_3[O_3][O]
$$
ここで、$ ( k_1, k_2, k_3 ) $はそれぞれ反応速度定数を表します。
これをPythonで実装し、ODE(Ordinary Differential Equation)ソルバーを使用して解き、その結果をグラフ化します。
以下にサンプルコードを示します。
1 | import numpy as np |
このコードでは、scipyのsolve_ivp関数を使用してODEを解きます。
解をプロットすると、オゾン、酸素、および二酸化酸素の濃度が時間とともにどのように変化するかがわかります。
[実行結果]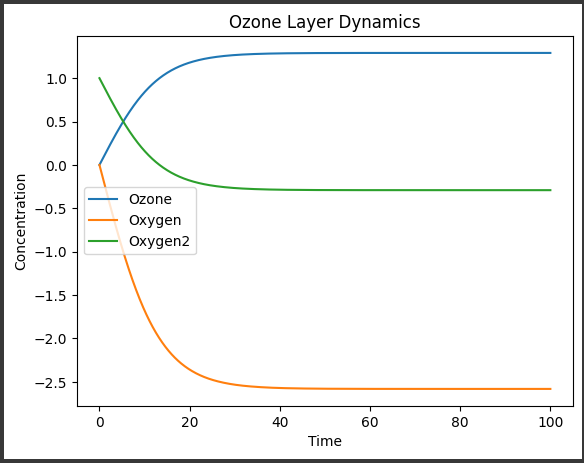
ソースコード解説
このソースコードは、Pythonを使用してオゾン層内の化学反応をモデル化し、その結果をグラフ化するものです。
以下では、コードの各部分を詳しく説明します。
- モジュールのインポート:
1
2
3import numpy as np
from scipy.integrate import solve_ivp
import matplotlib.pyplot as plt
numpyは数値計算を支援するライブラリです。scipy.integrate.solve_ivpは常微分方程式(ODE)を解くための関数です。matplotlib.pyplotはグラフを描画するためのライブラリです。
- パラメータの設定:
1
2
3
4k1 = 0.1 # 生成反応速度定数
k2 = 0.05 # 消費反応速度定数
k3 = 0.02 # 消費反応速度定数
UV = 1.0 # UV光の強度
- 化学反応の速度定数やUV光の強度などのパラメータを設定します。
- 反応方程式の定義:
1
2
3
4
5
6
7
8def ozone_equation(t, y):
O3 = y[0]
O = y[1]
O2 = y[2]
dO3dt = k1 * O2 * UV - k2 * O * O2 - k3 * O3 * O
dOdt = -2 * dO3dt
dO2dt = -dO3dt
return [dO3dt, dOdt, dO2dt]
- オゾン層内での化学反応を表す微分方程式を定義します。
tは時間、yは各物質の濃度を含むベクトルです。
- 初期値の設定:
1
y0 = [0.0, 0.0, 1.0] # [O3, O, O2]
- 時間$ ( t = 0 ) $における各物質の初期濃度を設定します。
- 時間範囲の設定:
1
t_span = (0, 100) # 0から100までの時間
- 解析する時間範囲を設定します。
- ODEを解く:
1
sol = solve_ivp(ozone_equation, t_span, y0, t_eval=np.linspace(0, 100, 1000))
solve_ivp関数を使って微分方程式を解きます。ozone_equationは定義した微分方程式、t_spanは時間範囲、y0は初期値、t_evalはグラフの時間点を指定します。
- 結果をプロット:
1
2
3
4
5
6
7
8plt.plot(sol.t, sol.y[0], label='Ozone')
plt.plot(sol.t, sol.y[1], label='Oxygen')
plt.plot(sol.t, sol.y[2], label='Oxygen2')
plt.xlabel('Time')
plt.ylabel('Concentration')
plt.legend()
plt.title('Ozone Layer Dynamics')
plt.show()
- 解析結果をプロットします。
- 時間に対する各物質の濃度を示します。
- グラフには、オゾン、酸素、および二酸化酸素の濃度が示されます。
結果解説
[実行結果]
上記のグラフには、時間とともにオゾン層内の各物質の濃度の変化が示されています。
各線は、それぞれオゾン$(O3)$、酸素$(O)$、および二酸化酸素$(O2)$の濃度を表しています。
- X軸は時間を表します。
- Y軸は各物質の濃度を表します。
- オゾン$(O3)$の濃度は、時間が経つにつれて増加または減少します。
これは、オゾンの生成と消費の両方の反応が進行しているためです。 - 酸素 $(O)$の濃度は、オゾンの消費反応によって増加します。
- 二酸化酸素 $(O2)$の濃度も、オゾンの消費反応によって増加します。
初期条件や反応速度定数などのパラメータによって、それぞれの物質の濃度の変化が異なります。
グラフからは、時間の経過とともにオゾン層内で起こる反応がどのように影響を与えるかが視覚的に把握できます。