化学反応の速度
ある化学反応があるとき、反応速度が時間とともにどのように変化するかを予測したいとします。
具体的には、1次反応(一般的な化学反応のタイプの一つ)を考えます。
まず、必要なライブラリと関数をインポートします。
1 | import numpy as np |
次に、反応速度定数($k$)と初濃度(初量)を設定します。
1 | # 反応速度定数 (1/s) |
次に、反応速度を表す微分方程式を定義します。
1 | # 反応速度を表す微分方程式の定義 |
次に、odeintを使用して微分方程式を数値的に解きます。
1 | # 初期条件 |
最後に、濃度と時間の関係をグラフに表示します。
1 | # グラフ化 |
このコードは、1次反応の化学反応速度を示し、反応が時間とともにどのように進行するかを予測し、それをグラフに表示します。
SciPyを使用して微分方程式を解く方法と、その結果を分かりやすくグラフ化する方法を示しました。
グラフ解説
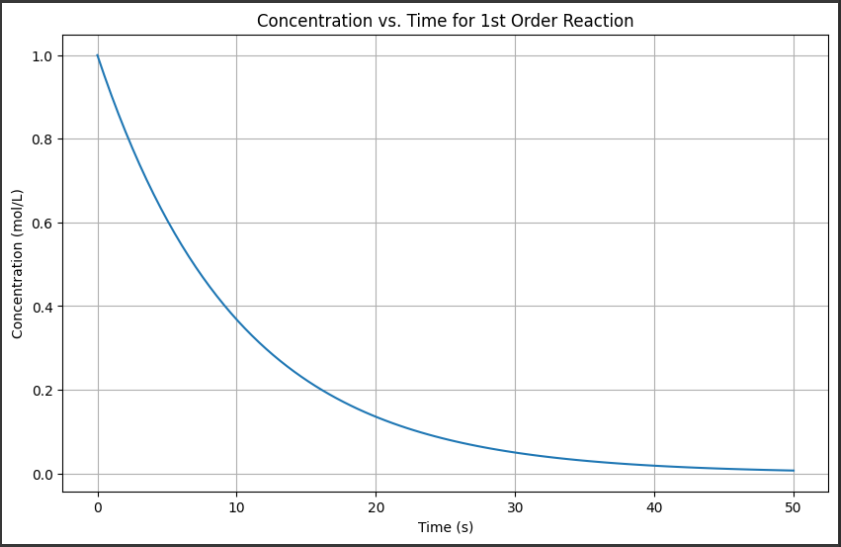
先ほどのコードで生成されるグラフは、1次反応の化学反応速度を示しています。
以下に、そのグラフの詳細な説明をします。
X軸(横軸):
時間(秒)を表しています。
時間は0秒から50秒の範囲でプロットされています。
これは反応が進行する時間を表しています。
Y軸(縦軸):
濃度($mol/L$)を表しています。
この軸は化学物質の濃度を示しており、反応が進行するにつれてどのくらい濃度が変化するかを示しています。
グラフの形状:
このグラフは指数関数的な減少を示しています。
最初の時点($t=0$)で初濃度が$1.0 mol/L$から始まり、反応速度定数($k=0.1 1/s$)に従って指数的に減少しています。
1次反応では、濃度は時間の経過とともに指数関数的に減少することが特徴です。
反応速度の変化:
初めは反応速度が速く、急激に濃度が減少します。
しかし、時間が経つにつれて反応速度は減少し、濃度の変化も緩やかになります。
これは1次反応の特徴で、反応物の濃度が減少するにつれて反応速度も減少します。
このグラフは、1次反応の化学反応速度が時間に対してどのように変化するかを視覚的に示しています。
初濃度から出発し、指数関数的に減少する濃度を観察することができます。
SciPyを使用して微分方程式を解くことで、化学反応の進行を数値的にモデル化し、その結果をグラフに表現することができました。
